Contexto e Desenho do Estudo
Retatrutida (LY3437943) é um novo fármaco de peptídeo único que ativatrês receptores simultaneamente: GIP, GLP-1 e glucagon. Para avaliar sua eficácia e segurança em indivíduos com obesidade, mas sem diabetes, foi conduzido um ensaio clínico de fase 2, randomizado, duplo-cego e controlado por placebo (NCT04881760). Um total de338 participantesPacientes com IMC ≥30 ou ≥27 com pelo menos uma comorbidade relacionada ao peso foram randomizados para receber placebo ou retatrutida (1 mg, 4 mg com dois esquemas de titulação, 8 mg com dois esquemas de titulação ou 12 mg) administrada uma vez por semana por injeção subcutânea durante 48 semanas.desfecho primárioA variável de desfecho foi a variação percentual do peso corporal em 24 semanas, com desfechos secundários incluindo a variação de peso em 48 semanas e limiares categóricos de perda de peso (≥5%, ≥10%, ≥15%).
Resultados principais
-
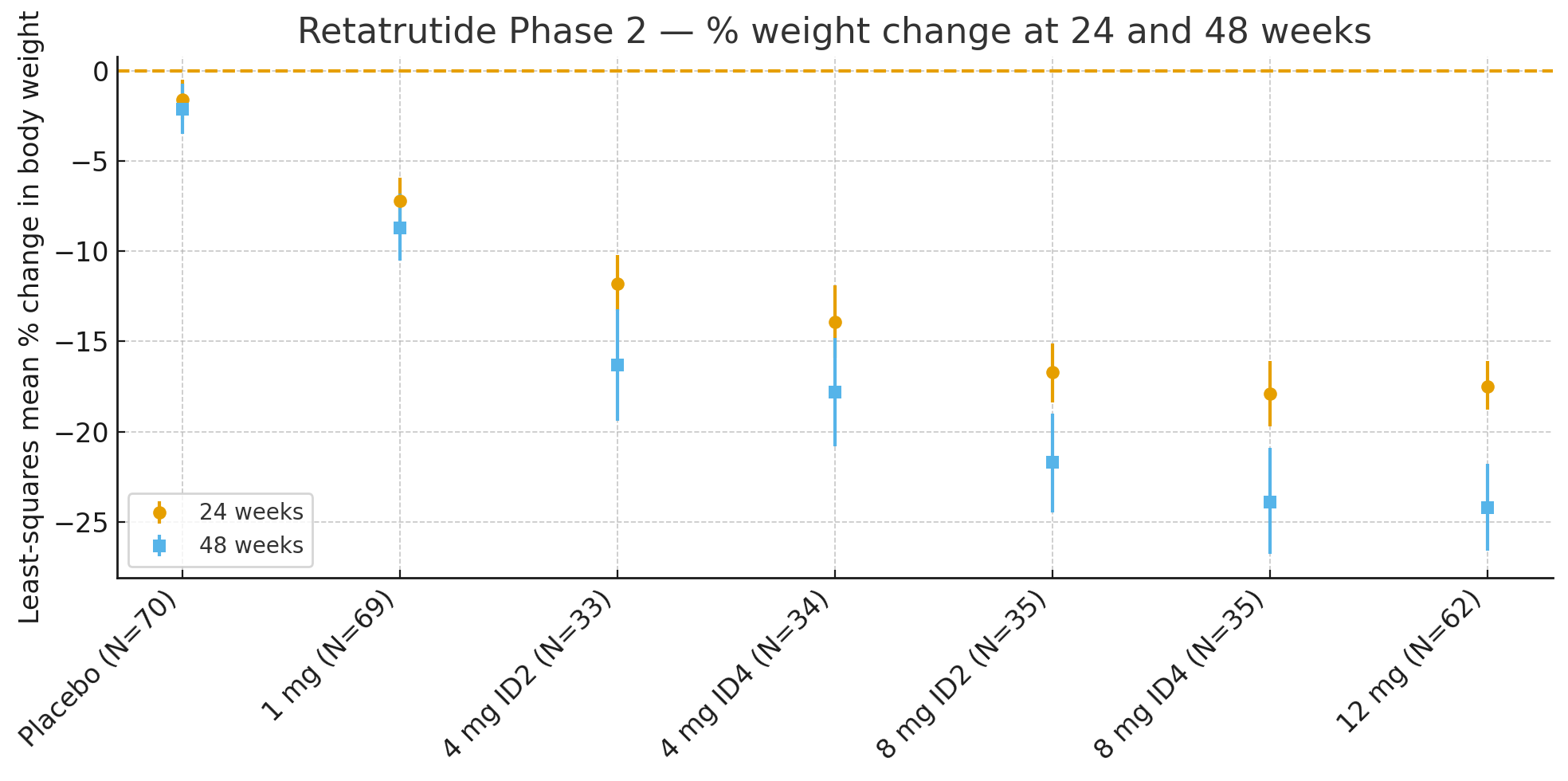
24 semanasA variação percentual média dos mínimos quadrados no peso corporal em relação ao valor basal foi de
-
Placebo: −1,6%
-
1 mg: −7,2%
-
4 mg (combinados): −12,9%
-
8 mg (combinados): −17,3%
-
12 mg: −17,5%
-
-
48 semanasA variação percentual no peso corporal foi de
-
Placebo: −2,1%
-
1 mg: −8,7%
-
4 mg (combinados): −17,1%
-
8 mg (combinados): −22,8%
-
12 mg: −24,2%
-
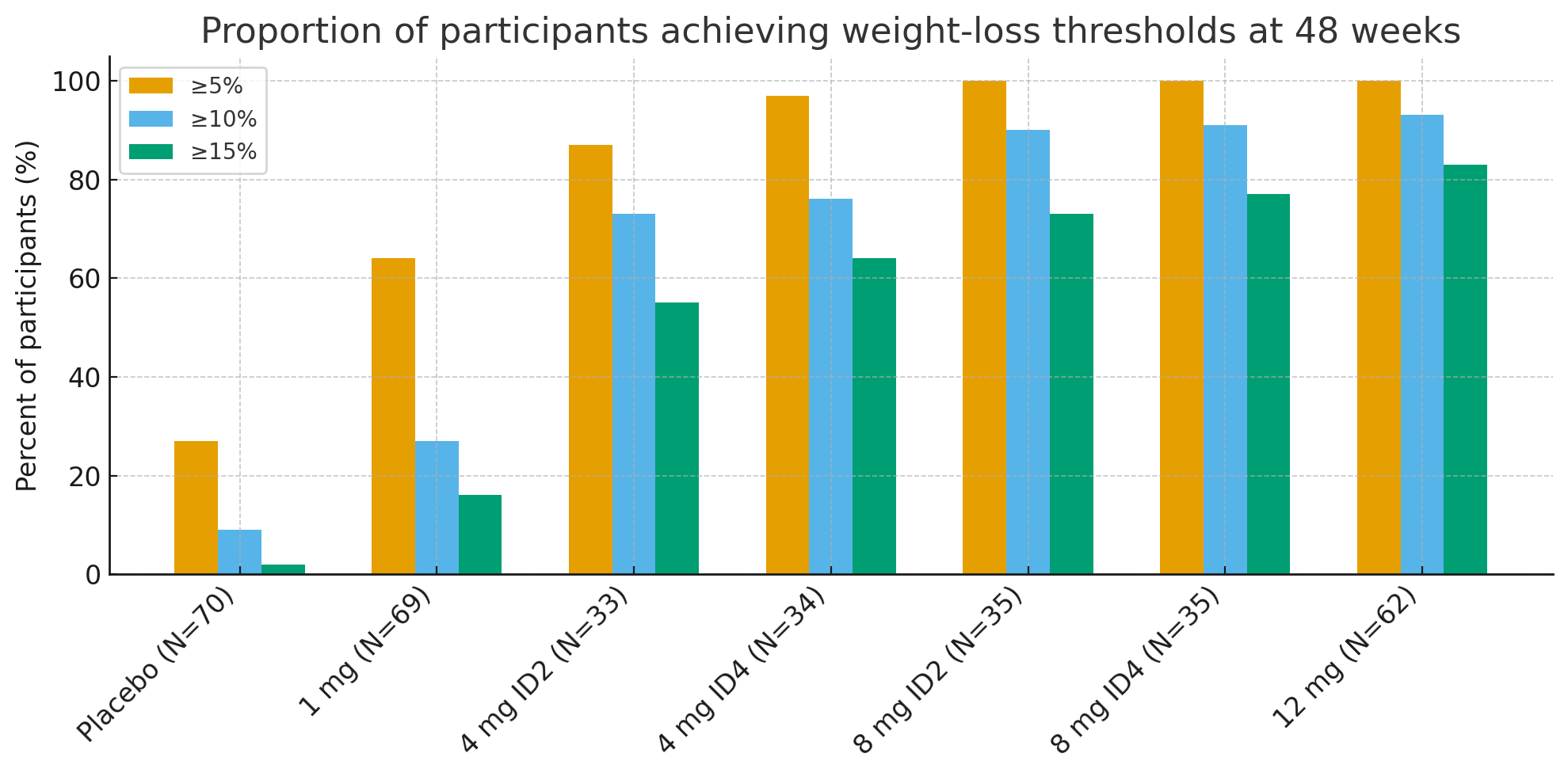
Após 48 semanas, a proporção de participantes que atingiram os limiares de perda de peso clinicamente significativos foi impressionante:
-
Perda de peso ≥5%: 27% com placebo vs. 92–100% nos grupos ativos
-
≥10%: 9% com placebo vs. 73–93% nos grupos ativos
-
≥15%: 2% com placebo vs. 55–83% nos grupos ativos
No grupo de 12 mg, até26% dos participantes perderam ≥30% do seu peso inicial., uma magnitude de perda de peso comparável à da cirurgia bariátrica.
Segurança
Os eventos adversos mais comuns foram gastrointestinais (náuseas, vômitos, diarreia), geralmente leves a moderados e relacionados à dose. Doses iniciais mais baixas (titulação de 2 mg) reduziram esses eventos. Observou-se um aumento da frequência cardíaca relacionado à dose, atingindo o pico na semana 24 e diminuindo em seguida. As taxas de descontinuação variaram de 6% a 16% entre os grupos ativos, sendo um pouco maiores do que no grupo placebo.
Conclusões
Em adultos com obesidade sem diabetes, a administração subcutânea semanal de retatrutida durante 48 semanas produziureduções substanciais e dose-dependentes no peso corporal(perda média de até ~24% na dose mais alta), juntamente com melhorias nos marcadores cardiometabólicos. Os eventos adversos gastrointestinais foram frequentes, mas controláveis com a titulação. Esses resultados da fase 2 sugerem que a retatrutida pode representar um novo padrão terapêutico para a obesidade, aguardando confirmação em estudos de fase 3 de maior porte e longo prazo.
Data da publicação: 28/09/2025